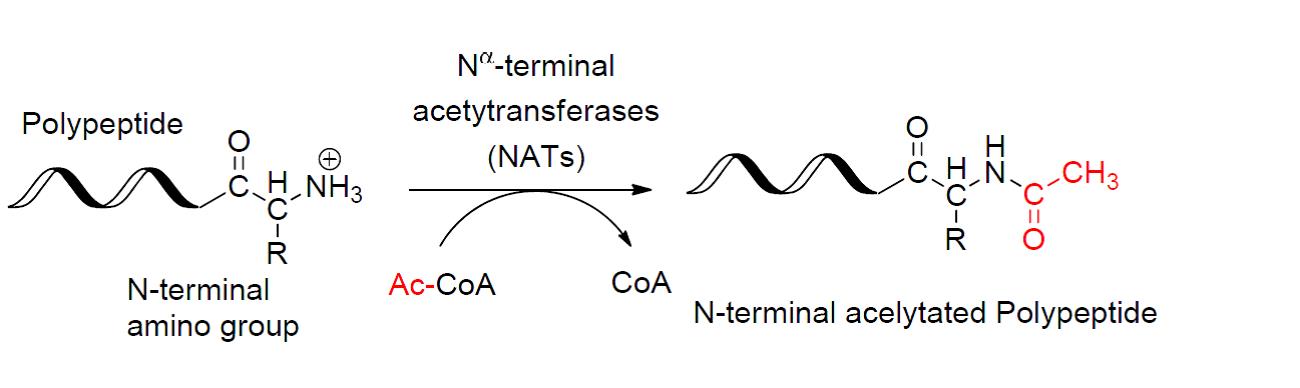
几乎所有的真核细胞蛋白质都通过不可逆和可逆的机制发生 N-乙酰化,或乙酰基转移到氮上。N 端乙酰化需要 N 端甲硫氨酸被甲硫氨酸氨基肽酶 (MAP) 裂解,然后用 N-乙酰基转移酶 (NAT) 用乙酰辅酶 a 的乙酰基取代氨基酸。这种类型的乙酰化是共翻译的,因为 N 端在仍与核糖体相连的生长中的多肽链上乙酰化。虽然 80 至 90% 的真核细胞蛋白以这种方式乙酰化,但其确切的生物学意义仍不清楚。
组蛋白 N 末端赖氨酸的ε-NH2 乙酰化(简称赖氨酸乙酰化)是调节基因转录的常用方法。组蛋白乙酰化是一个可逆的事件,可减少染色体浓缩以促进转录,这些赖氨酸残基的乙酰化受含有组蛋白乙酰转移酶 (HAT) 活性的转录因子调控。而具有 HAT 活性的转录因子作为转录共激活因子,组蛋白去乙酰化酶 (HDAC) 酶是共抑制因子,通过降低赖氨酸乙酰化水平和增加染色体凝聚而逆转乙酰化的作用。
Sirtuins(沉默信息调节因子)是一组 NAD 依赖性去乙酰化酶,靶向组蛋白。顾名思义,它们通过低乙酰化组蛋白维持基因沉默,据报道有助于维持基因组稳定性。
而乙酰化最早是在组蛋白中检测到的,胞浆蛋白也被报道是乙酰化的,因此乙酰化似乎在细胞生物学中发挥着比单纯的转录调控更大的作用。此外,乙酰化修饰和其他翻译后修饰,包括磷酸化、泛素化和甲基化之间的串扰,可以改变乙酰化蛋白的生物学功能。可通过使用乙酰赖氨酸特异性抗体的染色质免疫沉淀 (ChIP) 或通过质谱法检测蛋白乙酰化,其中组蛋白增加 42个复合的单位代表一个单一的乙酰作用。
HIT已经建立了一个高灵敏度的HPLC-MS/MS标准操作系统,可以分析真核生物和原核生物的蛋白质乙酰化翻译后修饰。此外,我们优化了相关实验方案,可快速、灵敏对乙酰化位点进行定位服务。
HIT乙酰化服务:
1.蛋白质的胶内酶解或溶液酶解
2. 针对特定乙酰化蛋白进行富集
3.HPLC分离,随后使用ESI-TOF MS/MS分析
4.质谱数据解析
HIT针对蛋白质翻译后修饰分析方面提供以下生物信息学服务:
1.功能注释和富集分析
2.聚类分析
3.网络分析
4.统计学分析
5.翻译后修饰的蛋白质组学分析



